有两只手撑起了当前的分子生物学研究:高通量测序技术和基因编辑技术。它们一个对基因组进行“读”,一个进行“写”。一个是dry lab的焦点,一个是wet lab的必需。一读一写间,基因组这部生命之书被科学家放于手掌里,翻来翻去、勾勾画画,书页上字里行间的密码逐渐被揭秘。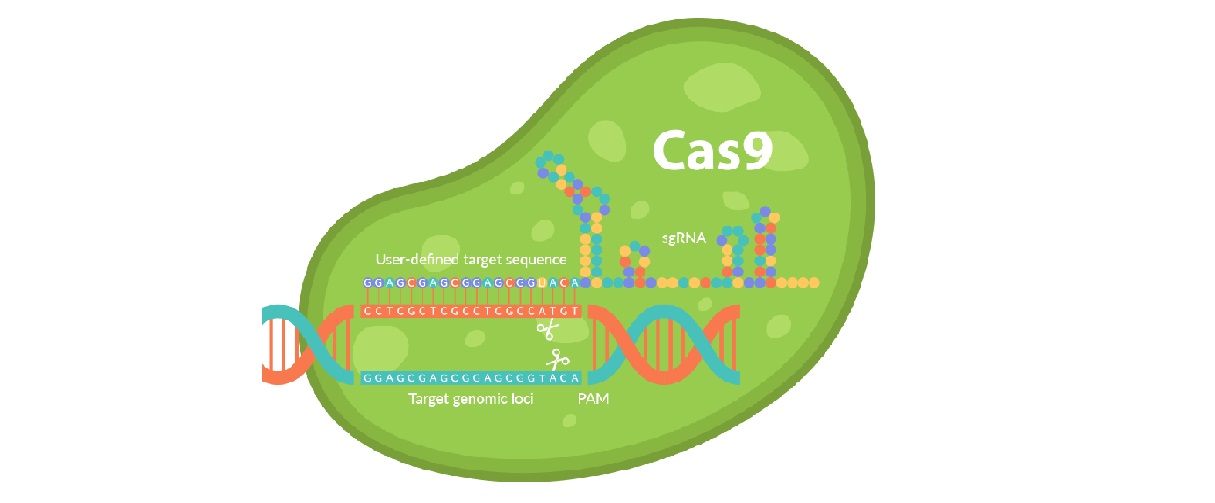
已经了解了高通量测序的方方面面,却忍不住好奇,想窥视一下到底怎样“写”基因组的。前段时间,自己参加了一个基因编辑的workshop。有过一些分子克隆的经历,所以能容易地学习CRISPR/Cas9。这种一种新颖的方法,但若只利用它的基本功能,其具体的分子生物学实验操作,与一般分子克隆别无二样。将学习所得写下来,供它日回顾这次学习经历。
1. 目的
CRISPR/Cas9有多种用途,更多奇思妙想的应用也不断出来。但它最常见的用途是用来实现特定基因的knock-out。当然也可以实现knock-in、site mutation、遗传筛选、治疗等,但更为复杂。
分子生物学实验中,为了实现Loss of function的目标,可以knock-out或knock-down目的基因。在knock-out技术里,CRISPR/Cas9比ZFN、TALENT等操作更容易、脱靶率也更低;与RNAi等knock-down相比,CRISPR/Cas9更为彻底。
2. 原理
CRISPR/Cas9技术基于两个生物学现象:细菌的CRISPR/Cas免疫和真核细胞的DNA修复。先破坏DNA,后修复DNA。在修复的过程,实现InDel、large deletion、insertion等。
CRISPR/Cas9实验操作过程中,CRISPR作为guide RNA精确引导Cas9蛋白攻击靶点DNA,造成DNA双键断裂(DSB),从而启动细胞内部的DNA修复过程。这个DNA修复过程完全依赖于真核细胞固有的修复系统,主要是负责DSB修复的非同源末端连接(NHEJ)和同源重组修复(HR)。CRISPR/Cas9实现knockout靶基因时,与NHEJ的非精确修复有关。
NHEJ的非精确修复,可以引起各种InDel突变。若InDel造成移码突变(frameshift),就实现了knock-out的目的。在提供donor时,以其为模板,可以通过HR进行精确的knock-in和point mutation (SNV, InDel)。若将Cas9修改成其它的酶,可以实现DNA序列修改之外的其它功能。
3. knock-out流程
3.1. sgRNA design and oligo DNA synthesis
设计时两个基本原则是high efficiency和low off-target

在线设计工具:CRISPR RGEN tools
3.2. sgRNA vector construction (Golden gate cloning)
实现多个DNA fragment的连接。依赖于type IIS restriction enzyme (BsaI, BsmBI, BbsI)和T4 DNA ligase。BsmBI等酶识别位点和切割位点是分离的,因此产生不同的non-palindromic末端。这类酶最大的优势在于可以自由设计黏性末端,并且切除识别区域保证连接之后不会再被识别。所以可以同时加入多个片段,并且酶切和连接同时进行。
(以下其它步骤同一般分子克隆)
3.3. Cas9 vector
3.4. Transfection
lipofection or electroporation
3.5. Pick up single clone and identification
FACS — Genome DNA extraction — PCR — T7E1 assay | TA clone sequencing


